 云 南 三 硕 科 技
云 南 三 硕 科 技
人参皂苷Rg1和Rf是原人参三醇(PPT)型皂苷的典型同分异构体,二者分子式均为 C₄₂H₇₂O₁₄,分子量相同(理论精确质量 [M-H]⁻ m/z 799.4834),但其糖链连接位置不同:
Rg1:C-6位连接一个葡萄糖(Glc),C-20位连接两个葡萄糖(Glc-Glc)。
Rf:C-6位连接一个葡萄糖(Glc),C-20位连接一个葡萄糖和一个鼠李糖(Glc-Rha)。
通过LC-MS区分两者的核心策略:
色谱分离:优化保留时间差异。
高分辨质谱:验证分子式一致性。
串联质谱(MS/MS):分析糖基丢失顺序及特征碎片离子。
提取:人参粉末(100 mg)用70%甲醇超声提取30 min,离心取上清。
SPE净化:通过C18固相萃取柱去除色素和脂质干扰,甲醇洗脱后氮吹浓缩至干,复溶于初始流动相(乙腈-水=20:80)。
避免降解:低温(4℃)保存样品,防止皂苷水解。
基质效应评估:通过加标回收实验验证提取效率(目标回收率≥80%)。
色谱柱:反相C18柱(如Waters Acquity UPLC HSS T3,2.1×100 mm,1.8 μm),适合极性皂苷分离。
流动相:
A相:0.1%甲酸 + 5 mM甲酸铵(增强离子化效率)。
B相:乙腈(含0.1%甲酸)。
梯度程序(仅供参考)

流速:0.3 mL/min;柱温:35℃;进样量:2 μL。
保留时间差异:
Rg1:~9.8 min
Rf:~10.5 min
分离度(Rs):Δ保留时间≥0.7 min,Rs≥1.5。
峰对称性:对称因子(As)0.9–1.1,避免拖尾影响定量。
仪器:Orbitrap Exploris 480(分辨率120,000 @ m/z 200)或Q-TOF(分辨率40,000)。
电离模式:ESI负离子模式([M-H]⁻)。
离子源参数:
喷雾电压:-2.8 kV
毛细管温度:320℃
鞘气流速:35 arb
辅助气流速:10 arb
全扫描(Full Scan):m/z 100–1500,分辨率≥70,000(Orbitrap)。
平行反应监测(PRM):
选择母离子m/z 799.4834,采集所有子离子(分辨率≥35,000)。
碰撞能量(CE):优化至25–40 eV(产生特征碎片)。
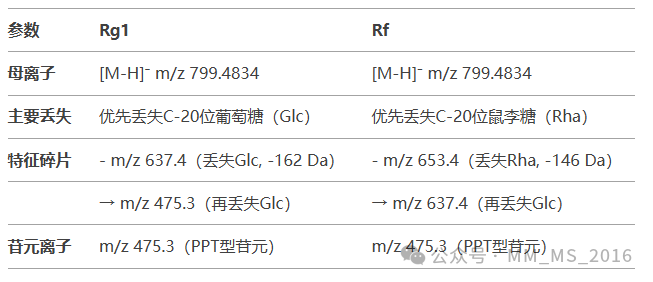
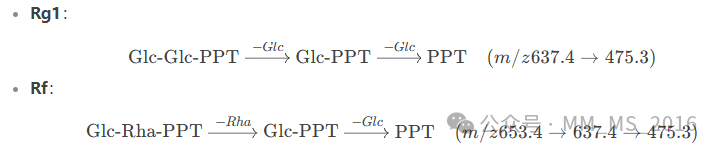
Rg1:提取m/z 799.4834±2 ppm,保留时间9.8 min。
Rf:提取m/z 799.4834±2 ppm,保留时间10.5 min。
理论同位素分布(C₄₂H₇₂O₁₄⁻):主峰m/z 799.4834,同位素峰m/z 800.4868(¹³C₁)。
匹配度:实测同位素丰度与理论值相似度≥90%(使用软件如Compound Discoverer™)。
内标法:使用同位素内标Rg1-¹³C₆([M-H]⁻ m/z 805.5035)。
标准曲线:0.1–100 ng/mL,R²≥0.995。
LOQ:0.1 ng/mL(S/N≥10,质量误差<3 ppm)。
解决方案:
优化流动相梯度(如延长洗脱时间或调整乙腈比例)。
更换色谱柱(如使用苯基柱或氰基柱)。
解决方案:
采用多级碎裂(MS³)获取更精细的碎片信息。
结合同位素标记或衍生化反应引入质量标签。
解决方案:
使用平行反应监测(PRM)或选择性离子监测(SIM)提高灵敏度。
富集样品(如固相萃取SPE)。
通过LC-MS联用技术分析同分异构体的核心步骤为:
色谱分离:优化保留时间差异以实现基线分离。
高分辨质谱:精确测定m/z,排除分子量相同的物质。
串联质谱:解析基团丢失顺序与分子碎片,确定异构体结构。
多维数据验证:结合保留时间、碎片离子及文献数据库交叉验证。